一、仪器基本信息
仪器型号:N-STORM
生产厂家:尼康
购置时间:2025.5
所属技术服务部:微纳结构技术研发部
放置位置:科技大楼1楼超分辨显微成像室
管理人员:苏专专 15799094953
仪器应用:N-STORM(Stochastic Optical Reconstruction Microscopy)是一种基于单分子定位的超分辨率显微技术,能够将光学显微镜的分辨率提升至纳米级别(横向分辨率约20 nm,轴向分辨率约50 nm)。使用超分辨显微镜 N-STORM 时,需先按顺序启动仪器,用电脑登录系统并选择对应模式。调整镜头和激光参数,通过实时观察调整图像质量,曝光采集数据,结束后按顺序关机,并注意样本制备和保存条件。
二、仪器操作流程
1. 操作前准备
培训要求:新用户需通过预培训(提前24小时联系管理员)和现场指导,未经培训禁止上机。
环境与着装:穿实验服进入平台,确认物镜清洁无油污,检查激光器冷却系统状态。
2. 样品制备:
(1) 清洗Lab-Tek®Ⅱ 八孔板的底部玻片,用1M KOH浸泡15 min,用超纯水冲洗干净,在超净台里用UV紫外消毒30 min;
(2) 将细胞以50-60%的密度种在八孔板的每个孔内;3.用500 μL PBS冲洗一次;
(3) 室温下,用200 μL固定液固定10分钟,
(4) 用200 μL替换液 NaBH4替换掉固定液,在摇床上轻摇7分钟,此后除了第12步和第14步,其他都需要在摇床上轻摇;
(5) 500 μL PBS 洗3次,每次5分钟口,轻摇
(6) 200 μL Blocking buffer轻摇20分钟
(7) 弃掉Blocking buffer;
(8) 加入150 μL一抗稀释液,室温下轻摇30分钟
(9) 用200 μL Washing Buffer 洗5次,每次15分钟,轻摇
(10) 加入150 μL二抗稀释液,室温下轻摇30分钟,需避光
(11) 用200 μL Washing Buffer洗3次,每次10分钟,轻摇;
(12) 500 μL PBS洗一次,5分钟,轻摇:
(13) 用固定液进行后固定,静置10分钟
(14) 用500 μL PBS 洗3次,每次5分钟:
(15) 存放在PBS中,如果要保存较长时间,建议加入20mM看氮化钠
(16) 使用STORM专用探针(如Alexa Fluor 647、Cy3-Cy5染料对),标记目标蛋白。
3. 仪器启动流程
(1)开机顺序:





- 按机身标注顺序开启1-5号开关。

选择桌面“NIS-Elements-AR-5.4.2”
- 电脑登录密码:nikon,选择N-STORM系统进入操作界面。
(2)样品固定

物镜上滴加一滴硅油。


将八板板或者共聚焦小皿等置于操作台上,并用夹子固定

点击PFS,并调整物镜高度,直到听到“嘀嗒”声,则到达焦面。
具体参考视频操作

物镜选择界面选择100X,并右键点击如图中位置,进行焦面二次聚焦。
(4) 物镜选择与切换:
Ø 点击软件界面镜头图标切换物镜(满色表示切换成功):
Ø 硅油物镜(如CFI SR HP Plan Apochromat 100XC Sil):用于活细胞/组织深层3D成像,折射率匹配活细胞。
Ø 普通油镜(如`CFI SR HP Apochromat TIRF 100X Oil):固定细胞样本常规成像。
4. 成像操作步骤
(1)样本定位:
使用Eye分区下的DAPI通道预览样本,通过蓝染细胞核定位目标区域。
(2)参数设置:
Ø 激活/激发激光:依次开启405nm(激活)、561nm/633nm(激发)激光,能量调整范围建议5-20%。
Ø 曝光与增益:
Ø 初始设置:曝光时间20-50ms,sCMOS相机增益300-500,确保单帧光子数在4000-10000区间(优化信噪比)。
Ø 高速模式:选择20×20μm视野,采集速度500Hz(活细胞动态观测)。
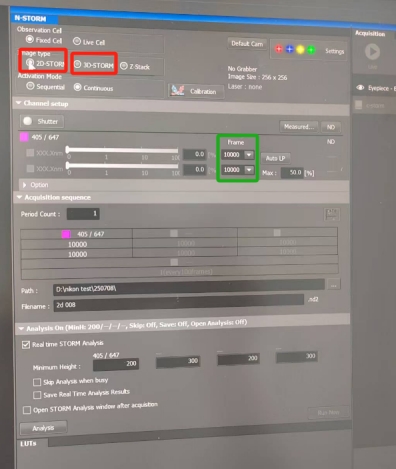
选择2D或者3D进行参数设置,并对帧数进行选择,初次成像一般选择10000帧,若成像连续性比较差,二次成像可选择20000~50000帧进行成像。
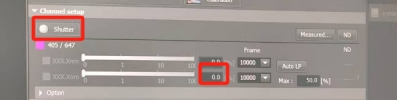
点击shutter,将647驱动光从0.5%开始逐步加强,直至100%,将分子驱动至“暗态”
驱动10 秒之后


选中405激发光进行激发,并点击“run now”进行扫描成像。
(3)漂移校正:
加入荧光小球(100nm金颗粒),勾选`Drift Correction`,系统自动计算XYZ轴漂移并实时补偿。
(4)图像采集与重构:
点击Run Now开始采集,系统自动记录数万帧原始数据。
软件执行单分子定位(高斯拟合)及3D重构(柱面镜分析Z轴形变)。
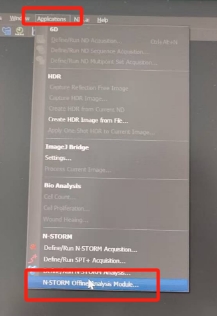
成像完毕之后,选择主菜单Application下拉最后一个选项“N-storm。。。”
选择成像的文件,导入刚拍摄的结果。
选择“Start N-storm Analysis”
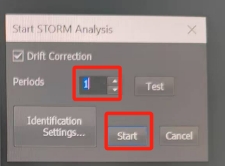
一般选择逐帧分析,然后开始分析。
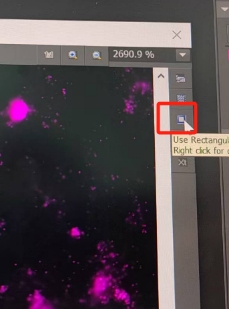
分析结束,选择右侧工具栏图中按钮,进行区域选择放大,左键选中,右键确认,并单击主菜单相机按钮。
出现的新界面左下角进行颜色选择,一般选择红色或者绿色。
操作界面空白处右键
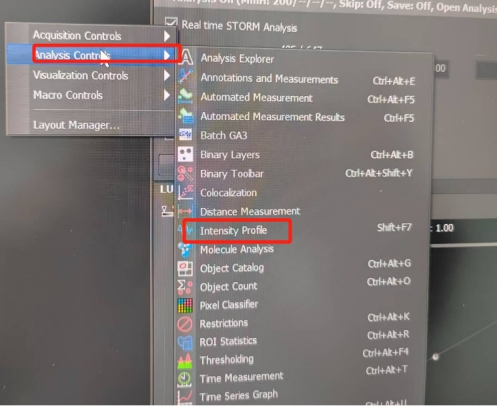
选择“analysis controls”右开菜单选择“intensity profile”
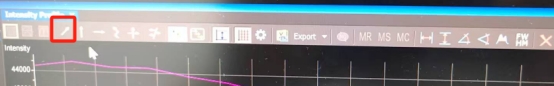
选择箭头,在放大的图片中,选择能分辨的两个点
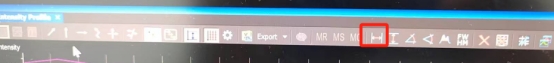
2D成像则选择图中按钮,进行粒子之间距离测定,若是3D成像,可选择右侧按钮进行粒子距离测定
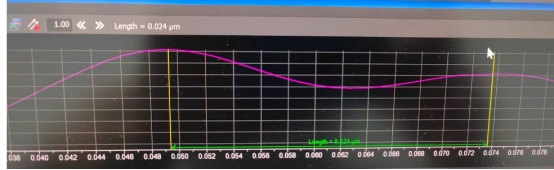
如图所示,所测试的两个分子之间的距离是24 nm。
(5)多色成像:
Ø 顺序激活法:切换不同活化激光(如405nm→488nm→561nm),分别采集各通道。
Ø 连续激活法:单染料多色成像时,调整激光强度比例避免通道串扰。
4. 关机流程
1. 关闭激光和`Live`模式,保存数据(`File → Export`,勾选标尺)。
2. 物镜清洁:用无水乙醇擦拭油镜,硅油物镜需专用清洁纸,确认无残留。
3. 按8→1逆序关闭开关,填写《仪器状态登记表》并扫码上报。
三、仪器注意事项(或相关管理规定)
1. 物镜与样本处理
物镜保护:
Ø 硅油物镜严禁接触普通镜油,使用后立即清洁,否则可能永久损伤涂层。
Ø 违规留污将触发平台处罚(如禁用账号、赔偿)。
Ø 样品兼容性:STORM需特殊制样(如抗淬灭封片剂),常规共聚焦样本可能不适用。
2. 激光安全与设备维护
激光安全:
Ø 勿直视激光出口,操作时佩戴防护镜;633nm激光功率超过5mW需申请安全许可。
Ø 漂移控制:
Ø 活细胞成像需开启温控(CO₂维持),避免呼吸漂移;长时程拍摄(>30min)需每1min校正漂移。
3. 数据与操作规范
Ø 存储管理:原始数据(.nd2格式)建议实时备份,单次实验数据量可达100GB。
Ø 违规禁令:
Ø 禁止在平台充电(手机/笔记本等),禁止未穿实验服操作,违者禁用权限。
---
表:成像模式参数设置指南
模式 |
视野尺寸 |
激光能量 |
曝光时间 |
适用场景 |
高速活细胞模式 |
20×20 μm |
405nm: 5% |
20ms |
囊泡运输、蛋白动态 |
|
|
561nm: 15% |
|
|
大视野固定样本模式 |
80×80 μm |
405nm: 10% |
50ms |
组织结构纳米成像 |
|
|
633nm: 20% |
|
|
3D-Stack多层成像 |
40×40 μm |
多平面Z轴 |
100ms/层 |
细胞器空间重构 |
总结
尼康N-STORM的操作核心在于精准控制单分子激活密度与实时漂移校正。严格遵循物镜清洁规范( 硅油/油镜分区分拭)、参数优化(光子数4000-10000)及环境稳定性控制(温控+防震台),可确保分辨率稳定在20nm(XY)及50nm(Z)。建议首次用户在管理员监督下完成全流程操作,避免因小失误导致设备损伤或数据失效。
